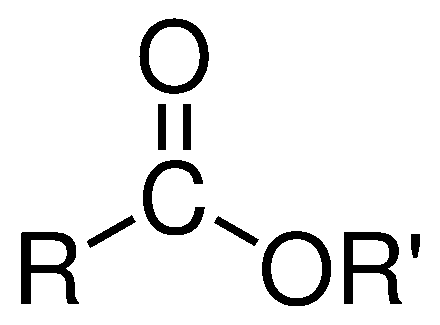
Son cadenas de carbono en las cuales están unidas por un oxígeno el cual contiene en una de sus cadenas un doble enlace con otro oxígeno. Su formula general es:
Obtención de ésteres:
Se obtiene cuando un ácido carboxílico reacciona con un alcohol, durante la reacción, el hidrógeno del grupo -OH del alcohol, se une al grupo -OH del ácido para formar una molécula de agua; la estructura sobrante del alcohol y del ácido se unen por medio del oxígeno presente.

Nomenclatura:
La nomenclatura de los ésteres deriva del ácido carboxílico y el alcohol de los que procede. Así, en el etanoato (acetato) de metilo encontramos dos partes en su nombre:
La primera parte del nombre, etanoato (acetato), proviene del ácido etanóico(acético)
La otra mitad, de metilo, proviene del alcohol metílico (metanol).
En el dibujo de la derecha se observa la parte que procede del ácido (en rojo; etanoato) y la parte que procede del alcohol (en azul, de etilo).
Luego el nombre general de un éster de ácido carboxílico será "alcanoato de alquilo" donde:
alcan-= raíz de la cadena carbonada principal (si es un alcano), que se nombra a partir del número de átomos de carbono. Ej.:Propan- significa cadena de 3 átomos de carbono unidos por enlaces sencillos.
oato = sufijo que indica que es derivado de un ácido carboxílico. Ej: propanoato: CH3-CH2-CO- significa "derivado del ácido propanoico".
de alquilo: Indica el alcohol de procedencia. Por ejemplo: -O-CH2-CH3 es "de etilo"
En conjunto CH3-CH2-CO-O-CH2-CH3 se nombra propanoato de etilo.
Propiedades Físicas:
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como dadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como dador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Muchos ésteres tienen un aroma característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales.
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser descompuestos por ácidos o bases fuertes.
Propiedades químicas:
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas.







